


化学九年级下册课题1 生活中常见的盐优秀课件ppt
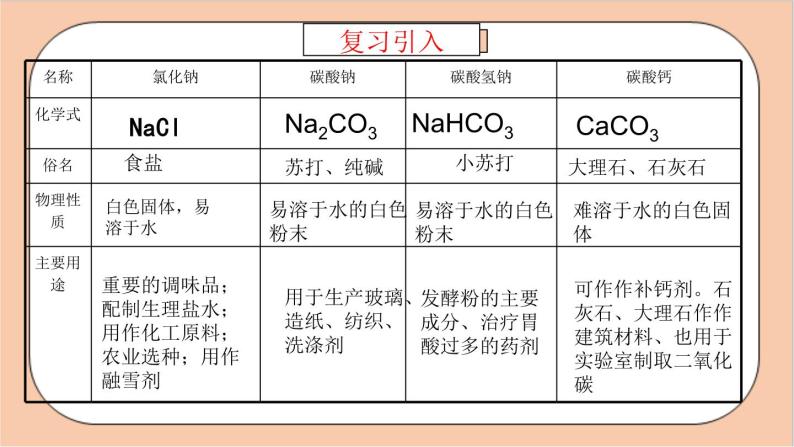
展开用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分、治疗胃酸过多的药剂
可作作补钙剂。石灰石、大理石作作建筑材料、也用于实验室制取二氧化碳
重要的调味品;配制生理盐水;用作化工原料;农业选种;用作融雪剂
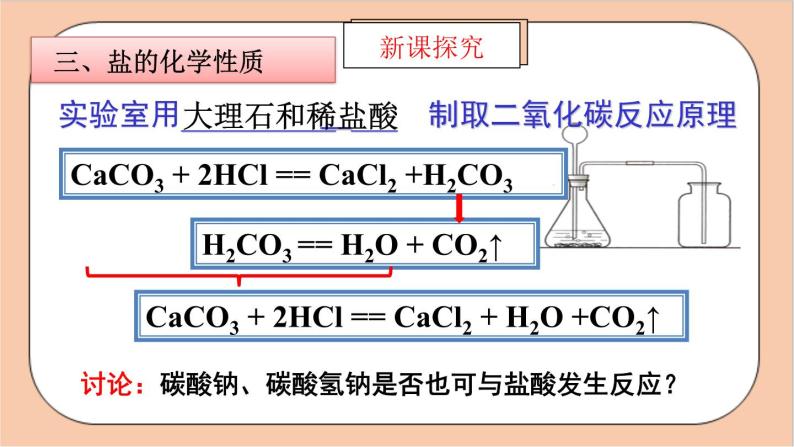
CaCO3 + 2HCl == CaCl2 + H2O +CO2↑
CaCO3 + 2HCl == CaCl2 +H2CO3
H2CO3 == H2O + CO2↑
讨论:碳酸钠、碳酸氢钠是否也可与盐酸发生反应?
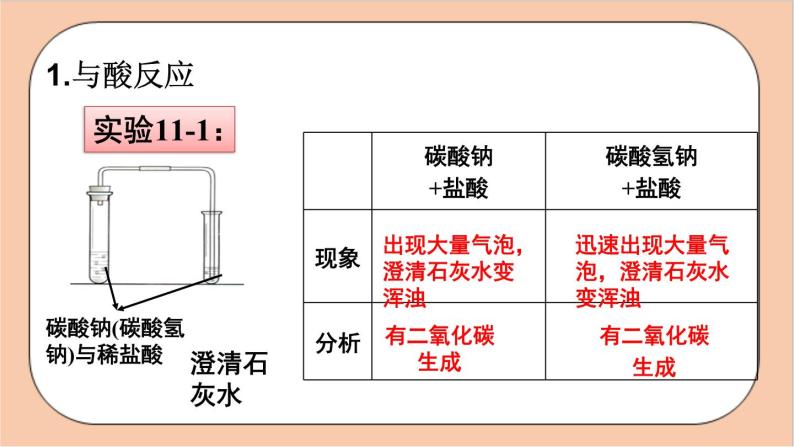
实验室用__________ ___ 制取二氧化碳反应原理
出现大量气泡,澄清石灰水变浑浊
迅速出现大量气泡,澄清石灰水变浑浊
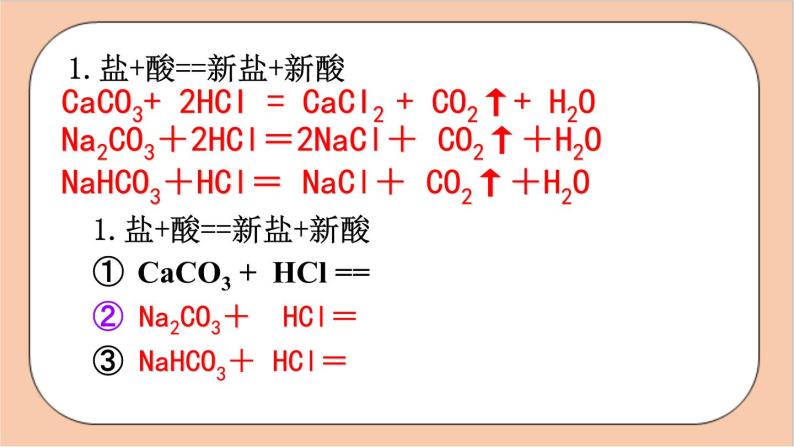
1.盐+酸==新盐+新酸CaCO3 + HCl == ② Na2CO3+ HCl=③ NaHCO3+ HCl=
Na2CO3+2HCl=2NaCl+ CO2↑+H2O
NaHCO3+HCl= NaCl+ CO2↑+H2O
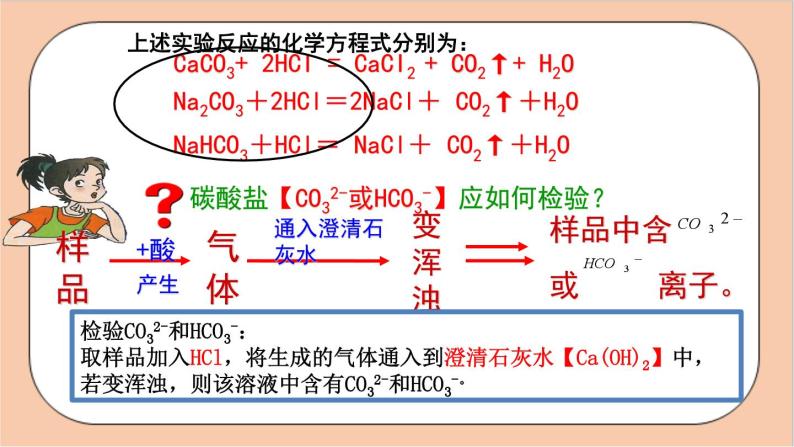
CaCO3+ 2HCI = CaCI2 + CO2↑+ H2O
碳酸盐【CO32-或HCO3-】应如何检验?
上述实验反应的化学方程式分别为:
检验CO32-和HCO3-:取样品加入HCl,将生成的气体通入到澄清石灰水【Ca(OH)2】中,若变浑浊,则该溶液中含有CO32-和HCO3-。
如何鉴别碳酸钠和碳酸氢钠?
产生能使澄清石灰水变浑浊的气体的是NaHCO3
2NaHCO3 Na2CO3+H2O+CO2
2.在溶液中加入相同溶液的盐酸
反应剧烈的是NaHCO3
3.溶解,加入氯化钙. 产生沉淀的是Na2CO3
Na2CO3+CaCI2=CaCO3 +2NaCl
出现白色沉淀
二者发生反应,生成一种难溶物
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水
CaCO3 ↓+ 2NaOH
Na2CO3+Ca(OH)2 ===
NaOH的工业制取: 用纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱
向成有少量NaCl溶液的试管,滴入AgNO3 溶液,观察现象
含有Cl- 能与AgNO3 溶液能反应产生白色沉淀且沉淀不溶于硝酸,证明含有Cl-
NaCl + AgNO3 = AgCl ↓ + NaNO3
向成有少量BaCl2 溶液的试管,滴入Na2SO4 溶液,观察现象
含SO4- 能与BaCl2溶液能反应产生白色沉淀且沉淀不溶于硝酸,证明含有SO4-
BaCl2 + Na2SO4 = 2 NaCl + BaSO4
滴加氯化钡或硝酸钡溶液产生白色沉淀,再加稀硝酸沉淀不溶解。
Na2CO3+ 2HCl === 2NaCl + CO2 ↑ + H2O
NaHCO3+ HCl === NaCl + CO2 ↑ + H2O
Na2CO3+Ca(OH)2 === CaCO3 ↓+ 2NaOH
观察这些反应,它们有什么共同点吗?
BaCl2 + Na2SO4 = 2 NaCl + BaSO4↓
两种化合物在反应时互相交换成分生成另外两种化合物的反应。
一般形式:AB + CD === CB + AD
特点:双交换,价(化合价)不变
请问:中和反应是不是复分解反应? HCl + NaOH == NaCl + H2O
答:中和反应是复分解反应。
1.下列化学反应不是复分解反应的是( )
A.CaCO3+2HCl==CaCl2+H2O +CO2↑B.CO2+Ca(OH)2=CaCO3↓+H2OC.Fe2O3+6HCl=2FeCl3+3H2OD.NaOH + HNO3=NaNO3 + H2O
复分解反应的发生是否需要条件?
实验11-3 向硫酸铜溶液里滴入氢氧化钠溶液。
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
实验11-3 向硫酸铜溶液里滴入氯化钡溶液。
CuSO4 + BaCl2 == BaSO4↓+ CuCl2
根据所提供的四种溶液,设计实验证明溶液两两之间是否能发生反应.√表示反应,×表示不反应
(1)BaCl2+H2SO4=(2)NaOH+H2SO4=(3)Na2CO3+H2SO4=
(4)BaCl2+ Na2CO3=(5)BaCl2+ NaOH =(6)Na2CO3 + NaOH =
BaCl2+H2SO4= BaSO4 +2HCl2NaOH+H2SO4= Na2SO4 + 2H2ONa2CO3+H2SO4= Na2SO4 + H2O + CO2 BaCl2+ Na2CO3= BaCO3 + 2NaClBaCl2+ NaOH =不反应Na2CO3 + NaOH =不反应
3.复分解发生反应的条件
两种化合物交换成分时,必需有沉淀或气体或水生成。
CaSO4 Na2SO4 NaClCuSO4 BaSO4 AgCl Na2CO3 CaCO3 CuCl2NaHCO3 NaNO3 BaCl2
盐在水中的溶解性各不相同
钾(盐)、钠(盐)、硝(酸盐)、铵(盐)溶;盐酸(盐)银不溶(AgCl不溶);硫酸钡不溶(BaSO4);(硫酸钡不钙银微)碳酸(盐)溶三位,钾、钠、铵为对;溶碱有五种,钾钠铵钙钡
注意:AgCl、BaSO4既不溶于水,也不溶于稀硝酸。
CaSO4 NaOH Na2SO4 AgCl Cu(OH) 2 NaCl Mg(OH) 2 BaCl2Ca(OH) 2 CuSO4 CuCl2 FeSO4 NaNO3 BaSO4 Fe(OH) 3 Na2CO3 KNO3 CaCO3NaHCO3 Ba(NO3) 2
由两种或两种以上物质生成另一种物质的反应
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
反应物和生成物都为化合物
反应物与生成物都是两种,且都是单质和化合物
由两种化合物互相交换成分生成另外两种化合物的反应
1.下列化学反应中,属于复分解反应的是( ) A. Fe + CuSO4 == FeSO4 + Cu B. 2H2 + O2 === 2H2OC. CO2 + 2NaOH == Na2CO3 + H2O D. NaOH + HCl == NaCl + H2O
2、判断下列复分解反应能否发生: H2SO4 + NaNO3——Na2SO4 + BaCl2——2HNO3 + K2CO3—— KNO3 + NaOH——
BaSO4↓+ 2NaCl
2KNO3 + CO2↑+H2O
1、AgNO3 + HCl --------2、 K2CO3+ Ca(OH)2--- 3、Na2CO3+ CaCl2 -----4、Na2SO4 + HCl -------
5、H2SO4 + BaCl2-------6、Ba(OH)2+ KCl ------7、CuSO4 + NH4NO3--- 8、HNO3 + NaOH -----
CaCO3↓+ 2KOH
CaCO3↓+2 NaCl
BaSO4↓+ 2HCl
NaNO3 + H2O
3.判断下列各组物质能否发生反应,能反应的写出化学方程式
4.下列各组物质中相互不能发生反应的是( ) A. 常温下,铝与氧气B. 铜与硝酸银溶液C. 氢氧化钠溶液与氯化钡溶液D. 氯化铁溶液与氢氧化钠溶液
5.下列各组物质的溶液混合后,不能发生反应的是( ) A.Na2CO3和H2SO4 B.NaOH和HCl C.NaCl和H2SO4 D.AgNO3和NaCl6.下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是( ) A.KCl溶液 B.K2CO3溶液 C.NaNO3溶液 D.稀盐酸7.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( ) A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
9.选择适当的化学式填写在横线上
(1)_________+Na2CO3=2NaOH+________(2)BaCl2+________=BaSO4↓+_________(3)________+2HCl=_______+_______+CO2↑
8.下列各组中的物质,能在溶液中共存的是 ( )A KNO3 NaCl NaOH B KOH Na2CO3 HCl C KNO3 NaOH FeCl3 D AgNO3 BaCl2 HNO3
10、要除去NaCl中混有的少量Na2CO3,选用的试剂是( )A. H2SO4溶液B. 稀盐酸C. K2SO4溶液D. AgNO3溶液
11、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。A、氯离子 B、硫酸根离子 C、碳酸根离子 D、氢氧根离子
原理:(1)NH3+H2O+CO2=NH4HCO3(首先通入氨气,然后再通入二氧化碳) (2)NH4HCO3+NaCl=NH4Cl+NaHCO3(NaHCO3溶解度最小,所以析出。) (3)2NaHCO3=Na2CO3+CO2↑+H2O(NaHCO3热稳定性很差,受热容易分解)
资料:石笋和钟乳石的形成
CaCO3+H2O+CO2==Ca(HCO3)2 Ca(HCO3) 2==CaCO3↓+H2O+CO2↑
1.盐+金属→新金属+新盐
2.盐+酸→新酸+新盐
3.盐+碱→新碱+新盐
4.盐+盐→新盐+新盐
Fe+CuSO4==FeSO4+Cu
BaCl2+H2SO4=BaSO4↓+2HCl
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
Na2CO3+CaCl2 =CaCO3 ↓+2NaCl
③碱+盐→新碱+新盐
①酸+碱→盐+水(中和反应)
⑤金属氧化物+酸→盐+水
复分解反应发生的条件:
反应物:无酸参加,必须可溶;生成物:必须有沉淀、气体、水三者之一。
酸 碱盐 盐
复分解反应的实质:酸、碱、盐之间在水溶液中解离出的离子相互结合,生成沉淀、气体或水的过程。
⑧ CuSO4 + BaCl2 == BaSO4↓+ CuCl2
⑤ CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
① HCl + NaOH == NaCl + H2O② H2SO4+Ca(OH)2 === CaSO4+ 2H2O
⑦ NaCl + AgNO3 = AgCl ↓ + NaNO3
④ NaHCO3+ HCl === NaCl + CO2 ↑ + H2O
③ Na2CO3+ 2HCl === 2NaCl + CO2 ↑ + H2O
⑥ Na2CO3+Ca(OH)2 ===CaCO3 ↓+ 2NaOH
人教版九年级下册课题1 生活中常见的盐精品ppt课件: 这是一份人教版九年级下册<a href="/hx/tb_c9873_t3/?tag_id=26" target="_blank">课题1 生活中常见的盐精品ppt课件</a>,共22页。PPT课件主要包含了NaCl,亚硝酸钠,NaNO2,正常的水分,生盐酸HCl,重要的化工原料,盐池盐湖等,蒸发结晶,混合物,过滤蒸发结晶等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐课文配套ppt课件: 这是一份人教版九年级下册<a href="/hx/tb_c9873_t3/?tag_id=26" target="_blank">课题1 生活中常见的盐课文配套ppt课件</a>,文件包含第3课时盐的化学性质pptx、3氢氧化钠和硫酸铜mp4、3氯化钡和硫酸铜mp4、3碳酸钠碳酸氢钠和盐酸mp4、3铁和硫酸铜mp4、3铜和硝酸银mp4等6份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐教学课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐教学课件ppt,共11页。PPT课件主要包含了通过这节课的学习,我还想学习,我体会到了,我收获了等内容,欢迎下载使用。













