

广东省深圳市宝安区2023-2024学年高三上学期期末考试 化学 Word版含解析
展开本试卷满分100分,考试用时75分钟.
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
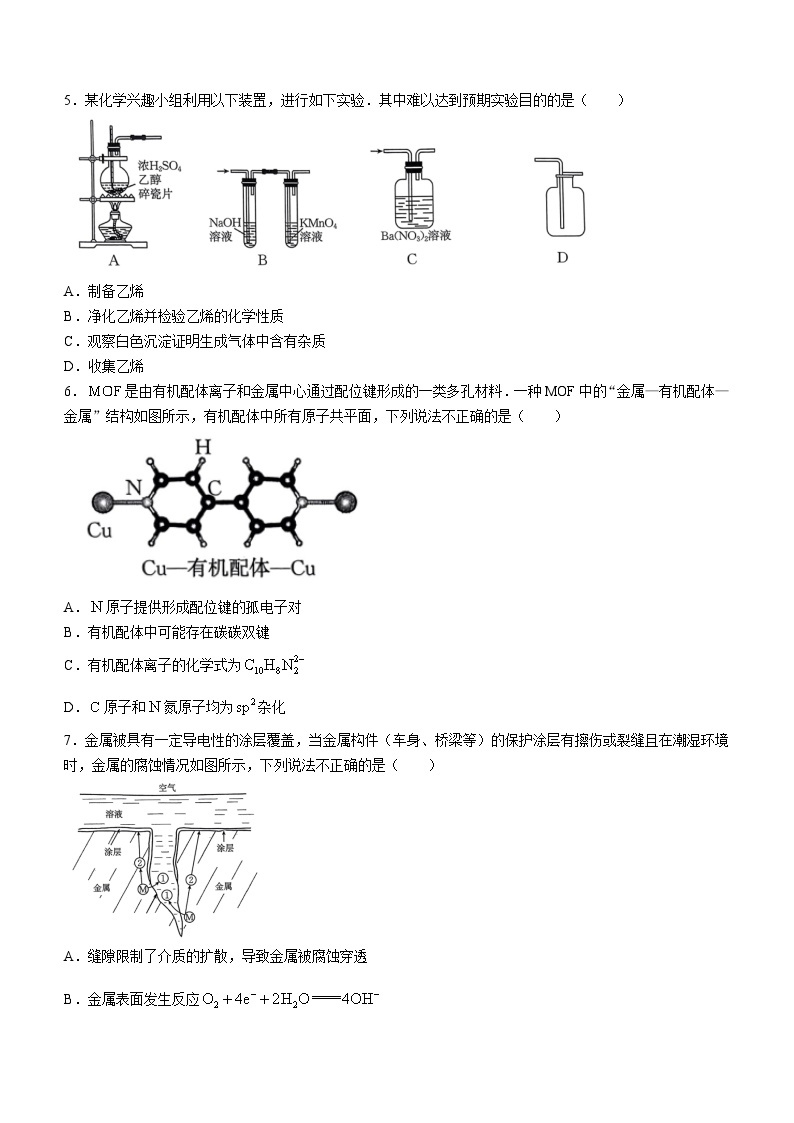
3.考试结束后,将本试卷和答题卡一并交回.
4.可能用到的相对原子质量:H 1 Lⅰ 7 C 12 N 14 O 16 Al 27 K 39 Fe 56 Sn 119
一、选择题:本题共16小题,共44分.第1~10小题,每小题2分;第11~16小题,每小题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.中国的饮食文化渊远流长,“八大菜系”久负盛名.下列有关说法正确的是( )
A.川菜“酸辣土豆丝”的土豆主要成分是难以消化的纤维素
B.湘菜“永州血鸭”的鸭血炒制过程涉及蛋白质的盐析
C.粤菜“客家酿豆腐”中只含有植物性蛋白质
D.鲁菜“糖醋鱼”的调料糖和醋属于纯净物
2.港珠澳大桥被誉为“现代世界新七大奇迹”之一,其中涵盖了当今世界岛隧桥多项尖端科技,下列说法不正确的是( )
A.大桥上铺设的高韧薄层励青来自石油化工产品的裂化与裂解
B.在幕墙铝材表面,使用特种涂料,可以提高铝材的耐腐蚀性
C.选用超高分子量聚乙烯纤维作为吊绳,可以降低大桥的重量
D.以水泥、植物纤维等物质合成的高密度外墙板可以防火防潮
3.在日常生活中,下列物质的使用涉及氧化还原反应的是( )
A.不锈钢餐具的使用 B.碳酸氢钠用于烘焙
C.漂白剂去除污渍 D.二氧化钛用于防晒霜
4.在氯碱工业生产中,安全检测员曾经使用浓氨水检验管道是否漏气,反应原理为.下列有关微粒的描述正确的是( )
A.氨分子的空间结构模型: B.氮气的结构式:
C.中子数为18的氯原子: D.氯化铵的电子式:
5.某化学兴趣小组利用以下装置,进行如下实验.其中难以达到预期实验目的的是( )
A.制备乙烯
B.净化乙烯并检验乙烯的化学性质
C.观察白色沉淀证明生成气体中含有杂质
D.收集乙烯
6.是由有机配体离子和金属中心通过配位键形成的一类多孔材料.一种MOF中的“金属—有机配体—金属”结构如图所示,有机配体中所有原子共平面,下列说法不正确的是( )
A.原子提供形成配位键的孤电子对
B.有机配体中可能存在碳碳双键
C.有机配体离子的化学式为
D.原子和氮原子均为杂化
7.金属被具有一定导电性的涂层覆盖,当金属构件(车身、桥梁等)的保护涂层有擦伤或裂缝且在潮湿环境时,金属的腐蚀情况如图所示,下列说法不正确的是( )
A.缝隙限制了介质的扩散,导致金属被腐蚀穿透
B.金属表面发生反应
C.钢铁被腐蚀时,微粒2是电子,微粒1是
D.在潮湿的空气中能生成铜锈
8.抗生素的正确使用拯救了无数人的生命,一种抗生素的结构如图.下列有关该抗生素的说法不正确的是( )
A.可以发生水解反应 B.含有3种含氧官能团
C.含有4个手性碳原子 D.该物质最多消耗
9.现用如图所示装置探究硝酸和铝反应的实验.下列说法不正确的是( )
A.反应时,硝酸仅做氧化剂
B.常温时,铝和浓硝酸接触没有明显现象
C.将注射器中的水加入试管,可能产生白雾
D.实验过程中闻到刺激性气味,该气体可能为
10.部分含或含物质的分类与相应化合价关系如图所示.已知氧化性,下列推断不合理的是( )
A.对于和都存在转化
B.与水蒸气反应生成
C.若溶液随的变化颜色加深,则其氧化性增强
D.若可作净水剂,则同时可以杀菌消毒
11.设为阿伏加德罗常数的值.氯碱工业相关产品包括氯气、氢气、氢氧化钠溶液、氯化氢、漂白液等.下列叙述正确的是( )
A.与所含质子数目相等,均为
B.氯气与足量氢氧化钠溶液反应转移电子数目为
C.溶液中,数目为
D.含有的共价键数目为
12.下列陈述均正确,且有因果关系的是( )
A.A B.B C.C D.D
13.科学家基于有机物的氧化还原性,发展了一种全固态可充电空气电池.电池充放电时原理如图所示,下列说法不正确的是( )
A.电极和之间的薄膜可能是质子交换膜
B.放电时,电极a区中有机物被还原为
C.充电时,电极为阳极,发生氧化反应
D.充电时,每生成,电极a区质量理论上增加
14.是原子序数依次增大的前四周期元素.其中由元素组成的化合物(如图)是一种高效净水剂,元素原子失去3个电子后的价层电子排布式为和的原子最外层电子数相同.下列说法正确的是( )
A.W、Y的第一电离能比其左边相邻元素的低
B.和形成的化合物中,的化合价一定为
C.简单离子半径大小:
D.和形成的化合物只含有离子键
15.工业上通常采用乙烯、水在磷酸催化下,压强下制备乙醇,其反应机理如图所示.下列说法不正确的是( )
A.高温高压有利于提高乙烯的转化率
B.第①步反应生成乙醇和
C.反方向,乙醇在一定条件下也可制得乙烯,但催化剂不同
D.该历程分三步进行,第①步反应速率最慢
16.氮、硫氧化物是造成大气污染的主要物质,已知与能发生反应.在一恒容密闭容器中,改变原料气配比进行多组实验(温度:),测得的平衡转化率部分实验结果如图所示.
下列说法正确的是( )
A.该反应的
B.点正反应速率一定大于点正反应速率
C.向点容器中再通入等体积的与,平衡正向移动
D.点时的平衡转化率为
二、非选择题:本题共4小题,共56分.
17.(14分)某实验小组欲在实验室制备气体,用于和溶液反应得到溶液,并探究温度和浓度对和碘酸钾反应速率的影响.回答下列问题:
(一)气体的制备
(1)仪器的名称是______________.
(2)实验结束后,小组成员取出铜片,发现圆底烧瓶底部产生灰白色沉淀,经查阅资料,猜想灰白色物质可能含有和.进行如下实验.
已知:
①实验任务:探究灰白色物质的具体成分.
②设计实验
首先,取该沉淀物多次洗涤并干燥,得到沉淀物试样.然后依次进行如下操作:
③交流讨论
有同学提出:仍然利用上述方法,可先检验,后检验,你的判断是______________(填“能”或“不能”,请说明理由:______________.
(二)温度、浓度对溶液和碘酸钾反应速率影响的探究
(3)实验原理:.
限选试剂:酸性溶液(含淀粉)、溶液、蒸馏水.
对照组实验:时,酸性溶液(含淀粉)溶液和蒸馏水混合.
①与对照组比较,升高温度对速率影响的实验现象为______________.
②设计浓度对速率影响的实验方案:时,向试管中依次加入溶液和蒸馏水,______________.
③实验操作时,小组同学发现向酸性溶液(含淀粉)中加入过量溶液时,蓝色溶液颜色逐渐裉去,其原因是______________(用离子方程式表示).
18.(14分)目前我国再生锡的生产地主要在广东清远、汕头、潮州等地区.在脆硫铅锑矿火法冶炼铅锑合金过程中,得到一种含铅、锑、锡的单质和氧化物的蒸余渣.某工厂采用如图工艺用蒸余渣制取合格的锡酸钠产品,设备简单,操作容易.
(1)均属于______________区金属,在化合物中若只是电子参与成键的,则一般会显______________价(填“低”或“高”).
(2)碱熔时三种元素的氧化顺序为,控制氧化剂的用量和反应温度可有效减少杂质的浸出.浸出渣的主要成分为______________.
(3)①操作Ⅰ包括______________、______________.
②在一定条件下,操作Ⅰ中液固比对浸出率的影响如下表所示.
生产中选择液固比为的条件,可能考虑的原因是______________.
(4)①“除铅”是使转化为沉淀的过程,其化学方程式为______________.
②“置换”时应加入的试剂是______________,可除去含______________元素的化合物.
(5)锡元素可以形成白锡、灰锡、脆锡三种单质.
①其中灰锡晶体结构与金刚石相似,但灰锡不如金刚石稳定,原因是______________.
②灰锡的晶胞参数为,计算锡的原子半径为______________.
19.(14分)随着新能源汽车产业崛起,废旧动力电池的回收、再利用受到重视.锂电池正极材料主要包括等,负极材料主要用石墨或硅碳复合材料,电解液为六氟磷酸锂的有机溶液.
(1)泄漏与水反应时,产生了沉淀、酸性气体和其他物质.
①写出与水反应的化学方程式:______________.
②中心原子上的核外价层电子对数为______________.
(2)中国科学家利用过渡元素离子存在轨道易配位特性,使用浸出系统,对正极活性材料中、和进行选择性浸出.作还原剂,以沉淀的形式留在浸出残渣中.关于浸出过程说法合理的是______________.
A.仅是一个沉淀转化的复分解反应
B.该过程发生了氧化还原反应
C.可与配位而不与配位
D.在反应中仅起反应介质作用
(3)科研小组用功率微波持续加热正极材料金属,并对其浸出过程进行研究,各金属浸出率和溶液中浓度变化如图所示:
①内用变化表示的反应速率为______________(保留两位有效数字).
②后浸出率降低的原因可能为______________.
(4)浸出液中含大量钠、锂、钴、镍的离子,用有机物HA萃取出钴,钠、锂和镍保留在溶液中.
①已知与有机物形成配合物的反应为,其稳定常数(稳定常数即生成配合物的平衡常数)为.则被完全萃取时,在水溶液中的浓度为______________{萃取后水溶液中的浓度可视为}.
②有机相可用溶液反萃取,经两步解离得和有机物.下,测得反萃取时水溶液中含钴微粒分布系数随变化如图.
则该温度下的平衡常数为______________(写出计算过程).
20.(14分)含氮杂环化合物的合成在生命物质制备以及新药研发等方面具有重大意义.一种以苯为主要原料合成ⅶ的路线如下(加料顺序、反应条件略):
(1)反应①中,在催化剂以及酸性条件下,化合物ⅰ与无色无味气体x反应,生成化合物ⅱ,原子利用率为,x为______________.
(2)根据化合物ⅱ的结构特征,分析预测其可能的化学性质,完成下表.
(3)有机物ⅲ的分子式是______________.化合物y是比ⅲ多两个“”的同分异构体,已知能发生银镜反应,且苯环上面的取代基为两个,则的同分异构体有______________种(不考虑立体异构),其中核磁共振氢谱显示5组峰,且峰面积之比为的同分异构体结构简式为______________(任写一种).
(4)关于反应⑥的说法中,不正确的有______________.
A.反应过程中,有双键和键断裂
B.反应过程中,有单键和双键形成
C.反应物ⅵ和产物ⅶ中碳原子采取的杂化方式相同
D.产物ⅶ中的所有碳原子和氮原子可能共平面
(5)以有机物A、B和D为含碳原料,分两步合成抗癌药物盐酸厄洛替尼片的重要中间体ⅷ,第2步利用反应⑥的原理.
(a)有机物D的化学名称是______________.
(b)第1步的化学方程式为____________________________.
深圳市宝安区高三期末考试
化学参考答案
1.B
【命题意图】本题考查化学与生活中对食物成分和化学反应的理解,包括营养物质糖类和蛋白质基本知识,纤维素的水解和蛋白质的盐析,糖和醋的类别判断等,使学生体会到化学知识存在于生活中的方方面面,理解化学在实际生产、生活中的重要地位,培养学生“科学精神与社会责任”的学科素养.
【解题分析】A项,土豆的主要成分是淀粉,不是纤维素.纤维素确实是人体不能消化吸收的多糖,而淀粉是可以被人体消化吸收的,因此,A选项是错误的.B项,考查蛋白质盐析的应用,在烹饪过程中,加入盐可以导致蛋白质的盐析,故B正确.C项,豆腐是由大豆制成的,大豆确实含有植物性蛋白质.然而,酿豆腐中还可能包含其他食材,如肉类,这些食材可能提供动物性蛋白质,故C错误.D项考查调料糖和醋的物质类别,醋属于混合物,故D错误.
2.A
【命题意图】本题以港珠澳大桥上面的新科技为情境,考查学生们金属的防腐,有机高分子材料,无机非金属材料,石油化工产品的利用在新材料中的应用.
【解题分析】A选项中的沥青主要来自石油化工中的减压蒸馏,石油的裂化和裂解可以得到乙烯、丙烯、甲烷等重要的基本化工原料,A选项不正确;B选项中利用涂料防腐,为金属防腐的常用方法,B选项正确;C选项中超高分子量聚乙烯纤维为高分子有机物,具有高强度、低密度的特点,C选项正确;D选项中的水泥和植物纤维合成的高密度外墙板,水泥可以防火,植物纤维具有超强吸附性,可随不同季节和早晚空气环境湿度的变化,不断地吸附和释放水分,自动调节室内湿度,可以起到防潮作用,D选项正确.
3.C
【命题意图】考查学生对性质和用途的理解,以及如何将这些性质与日常生活中的物品相联系.
【解题分析】不锈钢餐具主要是利用铁合金的良好物理性质;碳酸氢钠在烘焙过程中会发生化学反应,产生二氧化碳使面团膨张;二氧化钛在防晒霜中的作用是吸收紫外线;以上都没有涉及氧化还原反应.漂白剂主要成分是次氯酸盐,在与污渍反应时,次氯酸盐通过强氧化性去除污渍.
4.B
【命题意图】结合生产情境,考查学生对化学用语掌握的情况.
【解题分析】A中氨分子的空间结构模型应为三角锥形;中氯原子应表示为;中氯化铵的电子式为
5.D
【命题意图】本题以实验室制备乙烯实验为情境,考查学生对气体发生装置、除杂装置、检验收集装置的理解应用,考查典型气体制备与检验的基本方法.
【解题分析】浓硫酸条件下制备乙烯,A正确;溶液除去,高锰酸钾溶液检验乙烯的生成,B正确;通入硝酸钡溶液,产生的与形成硝酸,氧化生成后产生白色沉淀硫酸钡,C正确;乙烯密度与空气接近,不能用排空气法收集,收集乙烯要用排水法,D错误.
6.B
【命题意图】本题以(金属有机框架材料)为情境,考查学生原子杂化方式、配位化学、大键等分子结构方面的基础知识.
【解题分析】该“金属一有机配体一金属”结构中,与之间形成配位键,原子提供孤电子对,离子提供空轨道,A选项正确;有机配体中的所有原子共平面,则和原子之间形成大键,和原子都为杂化,不存在单独的碳碳双键,则B选项错误,D选项正确;该有机配体离子可以看作分子脱去两个形成的有机配体离子,C选项正确.
7.C
【命题意图】本题主要考查金属和电化学腐蚀的原理和过程,包括缝隙腐蚀、氧化还原反应、电子转移和铜的大气腐蚀等方面知识.
【解题分析】A项涉及金属腐蚀的一种形式一缝隙腐蚀.当金属之间存在缝隙,并且这些缝隙的宽度足够小,使得介质(如氧气、水等)的扩散受到限制时,缝隙内的金属就更容易被腐蚀.
B项描述的是金属表面发生的氧化还原反应.在金属的电化学腐蚀过程中,氧气通常会接受电子并与水反应生成氢氧根离子.
C项涉及钢铁腐蚀过程中的电子转移和铁离子的形成.在钢铁的电化学腐蚀中,铁会失去电子变成亚铁离子.
D项,在大气中,铜会与氧气、水和二氧化碳反应,生成碱式碳酸铜,也就是通常所说的“铜锈”.
8.C
【命题意图】本题以一种抗生素的分子结构为情境,考查学生有机物小分子中官能团及其反应、手性碳原子等方面的基础知识.
【解题分析】该抗生素分子中含有两个酰胺键,一个羧基,一个醚键,均为含氧官能团,该分子中的两个酰胺键在碱性条件下能发生水解反应消耗,羧基也会消耗,则A、B和D选项正确;该分子中只含有3个手性碳原子,C选项错误.
9.A
【命题意图】本题主要是对浓硝酸和铝反应的探究实验的考查.分别涉及硝酸的性质、浓硝酸和铝的钝化、稀硝酸和铝的反应产物探究,综合考查学生对教材基础知识的理解与掌握能力以及实验探究的能力.
【解题分析】A项当稀硝酸和铝反应时,硝酸既做氧化剂又起酸的作用,故A错误.B项考查浓硝酸和铝的钝化,没有明显现象,故B正确.C项考查浓硝酸的挥发性,浓硝酸加水稀释时,可能挥发出的结合试管上方的水蒸气形成水雾,推测可能看到白雾现象,故C正确.D项考查根据实验现象推断产物的能力,根据实验现象、反应物和元素守恒的原则,推测气体可能为氨气,故D正确.
10.B
【命题意图】本题以的价类二维图为情境,考查不同类别、不同价态物质的基本转化关系,考查溶液中的平衡及净水、杀菌消毒的应用.
【解题分析】单质均可生成二价盐,再转化为氢氧化物,最终被氧化为三价氢氧化物,A正确;与水蒸气反应生成,不生成更不活泼,不与水蒸气反应,B错误;若溶液随的变化颜色加深,即减小,浓度增大,氧化性增强,C正确;若可作净水剂,有强氧化性,可杀菌消毒,产生的水解生成胶体可以净水,D正确.
11.A
【命题意图】本题以氯碱工业为情境,体现化学在工业生产中的重要作用,考查学生对物质的量、化学键、水解等概念的理解与掌握情况,以及应用原子结构和氧化还原反应原理分析推理的能力.试题要求考生能从物质的量的视角定量分析化学变化.
【解题分析】质子数为质子数为与所含质子数目相等,均为,A正确;氯气与氢氧化钠溶液的反应为歧化反应,氯气转移电子数目为,B错误;为强碱弱酸盐,会水解,的溶液中,数目小于,C错误;是离子化合物,只在中含有共价键,D错误.
12.C
【命题意图】本题主要考查教材中的基础知识及其在实际生活的应用,分别涉及浓硫酸的性质、电解法、的氧化性和纯碱的性质,综合考查学生应用所学化学知识理论解释实际生活现象的能力.
【解题分析】A项考查浓硫酸和铁的钝化,发生了化学反应,其产物阻碍反应进行,故可用铁罐车运输浓硫酸,故A错误.B项考查电解法的应用,即金属防护的方法之一为外加电流法,被保护的金属铁应放阴极,故B错误.C项考查使用氯气进行自来水的杀菌消毒的原理,故C正确.D项考查碳酸钠用作治疗胃酸过多的胃药的原理,即碳酸钠和胃酸中的盐酸反应,使盐酸消耗,而不是因为其水解显碱性,故D错误.
13.B
【命题意图】本题以一种新颖的全固态可充电空气电池为情境,考查学生充放电时两电极的反应以及物质变化,电极之间的离子交换膜等电化学基础知识.
【解题分析】该电池为全固态可充电空气电池,放电时,在电极发生还原反应转化为,需要,则电极和之间的薄膜可能是质子交换膜,选项A正确;a电极中应该发生氧化反应,观察有机物和的结构,转化为是一个脱氧化的过程,则应该是电极区中有机物被氧化为,选项B不正确;放电时,电极发生还原反应,那么充电时电极作为阳极,发生氧化反应,C选项正确;充电时电极产生转移进a电极区,则电极a区质量理论上增加,D选项正确.
14.A
【命题意图】本题主要考查原子结构和元素周期律的知识.主要涉及电子排布式、离子半径大小比较、第一电离能、化学键及化合价的分析判断.
【解题分析】由题意:元素原子失去3个电子后的价层电子排布式为,可推知元素为,再根据化合物的结构式及原子序数依次增大可推知,为元素,为元素,最后根据和的原子价层电子数相同,可知为元素.
A项和原子的能级因失去1个电子后为半充满,能量较低,更稳定,故第一电离能比左边相邻元素低,故A正确.B项和形成的化合物有,硫元素的化合价分别为,故B错误.C项考查离子半径大小的比较,应为,故C错误.D项和形成的化合物有和,其中既有离子键,也有非极性键,故D错误.
15.A
【命题意图】本题以工业酸催化法制备乙烯的反应机理为情境,考查学生对反应历程中能量变化与速率平衡关系的理解,以及影响化学平衡因素的分析和应用能力.要求学生具有一定的信息获取与加工能力.
【解题分析】乙烯制乙醇为放热反应,高温不利于平衡正向移动,高温是为了加快反应速率,A错误.从反应过程中物质变化的历程图信息可知第三步反应生成乙醇和,B正确;实验室在浓硫酸、条件下由乙醇制得乙烯,C正确;反应经过三个能垒,第一个活化能最大,所以分三步,第一步为决速步,D正确.
16.D
【命题意图】本题考查化学平衡和反应速率相关的知识点,同时也涉及化学反应的能量变化和化学计算等模型认知核心素养.
【解题分析】A项,点的比点小,在温度不变的情况下,点平衡转化率应该比点大,但图中两点转化率均是,且温度,所以正反应是放热反应,故A项错误;B项,温度、浓度等均影响反应速率,点温度高,但浓度不一定高于点,所以点正反应速率不一定大于点正反应速率,故B项错误;C项,向点容器中再通入等体积的与,浓度商不变,平衡不移动,故C项错误;D项,由点可推得平衡常数,列三段式计算:
始/ 3 2 0 0
变/
平/
温度不变,平衡常数不变,则,解得,因此点时的平衡转化率为,D项正确.
(1)恒压分液漏斗(1分,答“分液漏斗”不得分)
(2)②(a)溶液先呈极浅蓝色,一段时间后,颜色逐渐变为深蓝色(2分,只答对一种颜色变化现象得1分)
(b)无水乙醇(或、四氯化碳等有机溶剂,1分)
(c)产生红棕色气体,固体全部溶解,溶液变蓝(2分,答对其中两个即得2分)
③不能;因为操作三中加入的浓硝酸也会与反应,出现相同的现象(1分,其他合理表述也得分)
(3)①升高温度时,溶液变蓝所需的时间缩短
②再加入酸性溶液(含淀粉),与对照组比较溶液变蓝所需的时间[2分,“”1分,“对照时间”1分]
③(2分,未配平扣1分)
【命题意图】本题主要考查对教材基本实验和实验异常现象的探究,分为两部分,第一部分是浓硫酸和铜反应的基本实验仪器考查和产物成分探究的考查,第二部分是探究温度和浓度对溶液和碘酸钾反应速率的影响.
【解题分析】(1)考查实验仪器名称,故答案为恒压分液漏斗.
(2)②对浓硫酸和铜反应产物成分的探究.根据题目已知反应方程式,可知和氨水反应的实验现象为溶液先呈极浅蓝色,在空气中放置一段时间后,颜色逐渐变为深蓝色.
为了将操作二之后的滤渣中的硫充分溶解除去,故加足量的无水乙醇进行溶解,过滤后再对滤渣进行处理.考查浓硝酸和反应的实验现象,故答案为产生红棕色气体,固体全部溶解,溶液变蓝.
③先检验,后检验的操作不可以,因为和浓硝酸反应的实验现象和一样,无法证明.故答案为不能,因为操作三中加入的浓硝酸也会与反应,出现相同的现象.
(3)考查温度、浓度对溶液和碘酸钾反应速率的影响.
①根据题目的反应原理可知,产物遇到淀粉变蓝,所以,比较速率快慢的实验现象为溶液变蓝的快慢.故答案为升高温度时,溶液变蓝所需的时间缩短.
②考查控制变量法的实验设计能力.根据题目所给对照组实验的数据,可知,保证溶液总体积为,因此加入的酸性溶液的体积必须为.故答案为再加入酸性溶液,与对照组比较溶液变蓝所需的时间.
③反应产生的会和过量溶液继续反应而被消耗完,溶液的蓝色会裉去.故答案为.
18.(1)p;低
(2)或(答也得分)(1分,多答和不扣分,也不给分)
(3)①加水溶解、过滤(2分,每步各1分,答“洗涤”不得分也不扣分)
(2)液固比为时,浸出率较高,且相对时提高程度较大,而时浸出率提高程度不大,而大的液固比将带来后续工艺的浓缩结晶时蒸发量的增大,从而增加了成本(共2分,其他合理答案也可给分)
(4)①(2分,未配平扣1分)
(2);
(5)①原子半径大(键长长、键能小),故灰锡不如金刚石稳定
②(2分,不写单位扣1分)
【命题意图】考查了化学学科中的金属的性质、氧化还原反应、沉淀溶解平衡、晶体结构等多个知识点.
【解题分析】(1)考查了金属的性质,要求了解在化合物中的成键方式和显价情况.这些金属都属于区金属,若只是电子参与成键,则一般显低价.
(2)根据氧化顺序推断浸出渣的主要成分.根据的氧化顺序可知,熔剂和的用量不宜过大,而应控制在适当的范围内,再结合流程中后继步骤中还存在除铅的操作,可判断出浸出渣中至少含有铅及其氧化物,因此,主要成分含有和.
(3)①由于碱熔是固相下的反应,因此操作1包括加水溶解、过滤和洗涤.
②根据表格数据可知,液固比为时,浸出率较高,且相对时提高程度较大,而时浸出率提高程度不大,另一个原因是大的液固比将带来后续工艺的浓缩结晶时蒸发量的增大,从而增加了成本,因此生产中选择液固比为的条件.
(4)①根据题目给出的信息可知,化学方程式为.
②根据工艺流程分析,在浸出液、溶液中均含有的化合物,结合置换反应的概念,加入的试剂必定是单质,从而置换出.
(5)①灰锡晶体结构与金刚石相似,但灰锡不如金刚石稳定,原因是锡原子半径比碳大,键长长,键能小,难以形成稳定的共价键,故灰锡不如金刚石稳定.
②键长为立方晶胞对角线的1/4,其为,故锡的原子半径为.
19.(1)①或(2分,未配平扣1分) ②6
(2)BC
(3)①
②加热时间长,温度升高使氨气挥发,不利于配位反应发生(不利于金属离子的浸出)(或其他合理答案,如生成配位离子的过程是化学键形成过程,反应放热,升高温度,平衡逆向移动)
(4)①
②
【命题意图】本题利用锂电池正极材料在水溶液及在有机萃取剂里的反应,考查反应速率、化学平衡等基础知识,涉及条件对化学平衡的影响、图像分析、化学平衡定量计算等实际应用问题.
【解题分析】(1)①为信息方程式的书写,酸性气体为,磷的化合价为正五价,故产物应为或,根据原子守恒配平即可.
②中心原子上的价层电子对键数+孤电子对数.
(2)正极材料中存在高价态的钴、镍、锰,用还原剂还原为价,故存在氧化还原反应,故A错误,B正确;C据题意价的钴、镍可与配位,而锰会生成沉淀,C正确;
沉淀时需要,故是反应物,D错误.
(3)①.
②加热时间增长使温度升高,浸出反应速率增大,浸出率应该升高.但由图知,后,浸出率没明显变化而浸出率减小,可推知原因与这两种离子与的配位平衡有关,离子配位相当于化合的过程,形成了新的化学键放热,同时受热易挥发.
(4)①本题考查对萃取的理解,被萃取后的离子要从水相进入有机相,此时水相中配位离子浓度很低,可视为,由可知.
②找出和相等时对应的,计算出浓度,代入平衡常数表达式求解.此题的易错点是萃取生成的有机物与水不相溶,不能计人平衡常数表达式.
20.(1)
(2);氧化反应;和;加成反应
(3);18;
(4)CD
(5)(a)甲醛
(b)
【命题意图】本题以有机合成为情境,全面考查有机物的性质与转化,包含有机物分子式、结构简式、反应试剂与条件、反应类型、反应方程式、有机物命名、同分异构体、分析有机反应中化学键的变化等.
【解题分析】(1)ⅰ的分子式为,ⅱ的分子式为,由于为无色无味气体且该反应原子利用率为,即可推出为.
(2)化合物ⅱ中含有的官能团为,当其转变为时,是一个被氧化的过程,反应试剂是(这里如果写成银氨溶液或者新制氢氧化铜不能给分,因为银氨溶液和新制氢氧化铜都是碱性环境,只能生成羧酸根);反应试剂是时,醛基中的双键会发生加成反应,新形成的官能团是和.
(3)化合物y是比ⅲ多两个“”的同分异构体,已知y能发生银镜反应,表明上面有一个,且苯环上面的取代基为两个,有如下6组情况:A.和;B.和;C.和;D.和;E.和;F.和,然后考虑邻、间、对的位置关系,则同分异构体有种.核磁共振氢谱显示5组峰,且峰面积之比为,表示有一个,且两个取代基处于对位的位置,则该结构可能有3种,如下所示:
(4)反应⑥是氨水、醛基、氨基和羰基一起形成含2个N原子的五元杂环过程,其中一个N原子来自氨基,一个N原子来自氨水,两个N原子之间的C原子来自醛基,选项A和选项B正确;反应物ⅵ中的原子均是杂化,ⅶ中的原子是和杂化,选项C错误;由于产物ⅶ中有一个原子是杂化,导致ⅶ中所有原子和原子不可能共平面,D选项错误.选项
陈述Ⅰ
陈述Ⅱ
A
常温时,铁遇浓硫酸不反应
可用铁罐车运输浓硫酸
B
铁的活泼性强于铜
外加电流法保护铁时铜作阴极
C
和反应产生强氧化性的
用于自来水杀菌消毒
D
溶液显碱性
可用作治疗胃酸过多的胃药
实验操作
实验现象
实验结论
操作一:取少量试样置于试管中,加入足量氨水,振荡;在空气中放置一段时间
(a)____________
成分含有
操作二:将操作一结束后的固体分离、洗涤、干燥,置于试管中,加入适量无水乙醇,充分振荡,静置、过滤,将滤液滴入蒸馏水中
溶液变浑浊
成分含有S
操作三:向操作二的滤渣中再加入足量(b),充分振荡、静置、过滤,将滤
渣洗涤后置于试管中,加入足量浓硝酸
(c)____________
成分含有
浸出液固比
浸出率/
82.32
91.56
92.75
93.98
序号
反应试剂
反应形成的新官能团
反应类型
还原反应
2024深圳宝安区高三上学期期末考试化学含解析: 这是一份2024深圳宝安区高三上学期期末考试化学含解析,共19页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。
广东省深圳市宝安区2023-2024学年高三上学期期末联考化学试卷: 这是一份广东省深圳市宝安区2023-2024学年高三上学期期末联考化学试卷,共19页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。
广东省深圳市宝安区2023-2024学年高三上学期期末联考化学试卷: 这是一份广东省深圳市宝安区2023-2024学年高三上学期期末联考化学试卷,共19页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。












