高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试学案
展开铝及其化合物
审稿:曹玉婷 责 编: 宋杰
【学习目标】
1、铝的性质;
2、铝的重要化合物及其相互转化。
【要点梳理】
要点一、铝
1.铝的原子结构和物理性质:
元素 符号 | 原子结构 | 原子半径 | 化合价 | 颜色 | 密度 (g·cm-3) | 熔点 ℃ | 沸点℃ | 硬度 |
13Al | 1.43×10-10m | +3 | 银白色 | 2.70 | 660.4 | 2467 | 较软 |
2.化学性质
Al-3e-=Al3+
(1)与非金属反应:
a、铝与氧气的反应。
【高清课堂:铝及其化合物】
实验探究:加热有氧化膜和无氧化膜的铝箔
实验步骤 | 实验现象 | 实验结论 |
(1)用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动,仔细观察 | 铝箔熔化,失去光泽,熔化的铝并不滴落 | 在常温下,铝能与空气中的氧气反应,生成一层致密的氧化物薄膜。加热时反应加剧,生成白色固体,放出大量的热,4Al+3O22Al2O3 铝是一种活泼金属,构成薄膜的Al2O3的熔点(2050℃)高于Al的熔点(660℃) |
(2)另取一块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至完全熔化,观察现象 |
b、与其它非金属反应:
2Al+3S Al2S3 2Al+3Cl2 2AlCl3
(2)与酸反应:
(3)与碱反应
2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 2Al+2H2O+2OH-=2AlO2-+3H2↑
要点诠释:
①铝是一种较活泼的金属,它并不直接与碱反应,铝与氢氧化钠溶液的反应,实际分两步进行:
首先要铝与水反应:2Al+6H2O=2Al(OH)3↓+3H2↑……①
由于生成的Al(OH)3覆盖在Al的表面,故看不到H2的生成;其次是生成的Al(OH)3是两性氢氧化物,它溶于NaOH:
Al(OH)3+NaOH=NaAlO2+2H2O……②
所以铝与NaOH溶液反应可以看到有气体产生。将两反应式按①+②×2合并,即得总反应式:2Al+2H2O+2NaOH= 2NaAlO2+3H2↑。所以在上述反应中Al是还原剂,H2O是氧化剂。其电子转移情况可表示如下:
②Al与酸、碱反应产生同量的H2,消耗Al的物质的量之比为1∶1,消耗盐酸和NaOH的物质的量之比为3∶1。
③酸、碱、盐可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
④铝热反应:Al +MxOy Al2O3+xM
铝热反应的应用:冶炼高熔点金属,如Fe、V、Cr、Mn等或焊接钢轨。
3.用途:铝主要用来制轻合金。
要点二、铝的化合物
1.氧化铝(Al2O3)
(1)物理性质:白色难熔固体、不溶于水。
(2)化学性质:Al2O3是典型的两性氧化物,既能与酸反应又能与强碱溶液反应。
与强酸:Al2O3+6H+=2Al3++3H2O
与强碱:Al2O3+2OH-=2AlO2-+H2O
(3)用途:耐火材料、制取铝的原料。
【高清课堂:铝及其化合物】
2.氢氧化铝[Al(OH)3]
(1)Al(OH)3的物理性质:Al(OH)3是不溶于水的白色胶状沉淀,是典型的两性氢氧化物,能凝聚水中的悬浮物,又有吸附色素的性能。
(2)Al(OH)3的两性:
当与强酸反应:Al(OH)3+3H+=Al3++3H2O(加酸促使电离平衡向碱式电离方向移动)
当与强碱溶液作用:Al(OH)3+OH-=AlO2-+2H2O(加碱促使电离平衡向酸式电离方向移动)
(3)Al(OH)3的制取:
①铝盐与碱反应:用铝盐与可溶性弱碱氨水反应制Al(OH)3:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
说明:制取Al(OH)3也可用铝盐与强碱作用,但应严格控制加入碱的量,因为强碱过量会使制得的Al(OH)3转化为偏铝酸盐:Al(OH)3+OH-=AlO2-+2H2O。所以,实验室一般不采用这种方法制Al(OH)3。
②偏铝酸盐与酸反应:一般用向偏铝酸盐溶液中通入CO2的方法制取Al(OH)3。
当CO2不足或适量时:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,
CO2过量时:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-。
说明:一般不用强酸,因为强酸的量控制不当会使制得的Al(OH)3溶解:
AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
(4)Al(OH)3的用途:净水。
明矾净水原理——明矾(KAl(SO4)2·12H2O)溶于水发生下列反应:
KAl(SO4)2=K++Al3++2SO42-
Al3++3H2O = 2Al(OH)3(胶体)+3H+
Al(OH)3胶体中胶粒有吸附水中悬浮杂质的作用,使其质量增大,沉降水底,达到净化水的目的。
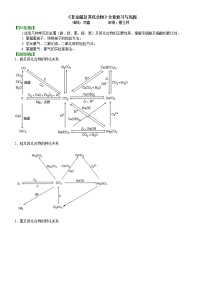
要点三、“铝三角”及其之间的相互转化
【高清课堂:铝及其化合物】
1.Al3+—→Al(OH)3
(1)可溶性铝盐与少量的强碱反应:Al3++3OH- (少量)=Al(OH)3↓
(2)可溶性铝盐与氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2.Al(OH)3—→Al3+
Al(OH)3+3H+=Al3++3H2O
3.Al3+—→AlO2-
可溶性铝盐与过量的强碱反应:Al3++4OH- (过量)=AlO2-+2H2O
4.AlO2-—→Al3+
偏铝酸盐溶液与足量的强酸反应:AlO2-+4H+=Al3++2H2O
5.AlO2-—→Al(OH)3
(1)偏铝酸钠溶液中加入少量强酸:AlO2-+H+ (少量)+H2O=Al(OH)3↓
(2)偏铝酸钠溶液中通入CO2:
2AlO2-+CO2 (少量)+3H2O=2Al(OH)3↓+CO32-
AlO2-+CO2 (过量)+2H2O=Al(OH)3↓+HCO3-
6.Al(OH)3—→AlO2-
Al(OH)3溶于强碱溶液:Al(OH)3+OH-=AlO2-+2H2O
要点诠释:(1)由Al3+制备Al(OH)3,宜用Al3+与氨水反应。一般不用强碱,因为过量的强碱会使Al(OH)3溶解转化为偏铝酸盐。
(2)由AlO2-制备Al(OH)3,宜用CO2与AlO2-反应。一般不用强酸,因为过量的强酸会使Al(OH)3溶解转化为铝盐。
要点四、有关Al(OH)3沉淀的图像分析及有关计算
1.相关图像
(1) NH3·H2O滴入AlCl3溶液中 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ | (2)CO2通入NaAlO2溶液中 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
(3)NaOH滴入AlCl3溶液中 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | (4)AlCl3滴入NaOH溶液中 Al3++4OH-=AlO2-+2H2O 3AlO2-+Al3++6H2O=4Al(OH)3↓ |
(5)HCl滴入NaAlO2溶液中 AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O | (6)NaAlO2溶液滴入HCl中 AlO2-+4H+=Al3++2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓ |
2.滴加过程中铝元素的存在形式分析
(1)向1 L 1 mol/L的AlCl3溶液中滴加NaOH溶液
(2)向1 L 1 mol/L的NaAlO2溶液中滴加稀盐酸
【典型例题】
类型一:铝与NaOH溶液的反应
例题1 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
【答案】A
【解析】2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
由反应方程式可知,若在等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比1∶3,现在产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,对于NaOH来说是不足量的,所以与盐酸反应的铝粉质量为2.7 g,与NaOH反应的铝粉质量为5.4 g。
【总结升华】因为铝与NaOH溶液反应是一个较为特殊的反应,所以当铝与NaOH溶液在同一题目中出现时,往往要用到2Al+2NaOH+2H2O=2NaAlO2+3H2↑这一关系来解。
举一反三:
【变式1】取两份等质量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同情况下产生的气体体积之比是( )
A.1∶1 B.1∶2 C.1∶3 D.3∶2
【答案】A
【变式2】把镁粉中混入的少量铝粉除去。应选用的试剂是( )
A、稀盐酸 B、新制氯水 C、烧碱溶液 D、纯碱溶液
【答案】C
【解析】盐酸跟镁、铝都能反应,故A错。氯水中存在Cl2,是强氧化性,金属都有还原性,镁铝都能和Cl2反应,同时,氯水中有Cl2和H2O反应生成的盐酸和次氯酸,这两种酸也都能和镁、铝反应,故B也不能选。烧碱是NaOH,铝可以跟NaOH溶液反应放出H2,而镁不反应而和铝分离,故C可选。纯碱溶液是碳酸钠溶液,镁、铝都不与之反应。
类型二:Al2O3、Al(OH)3的性质与制法
例题2 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是( )
①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 ⑤Al(OH)3
A.①②③⑤ B.①④⑤ C.②③⑤ D.①③④
【答案】C
【解析】注意审题,题目要求是“化合物”,防止错选A。
特别提示:两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物。两性氧化物有Al2O3、ZnO等,两性氢氧化物有Al(OH)3、Zn(OH)2等。定义中的酸指非氧化性强酸溶液,碱指强碱溶液,其实质是与H+和OH―反应。
弱酸的铵盐[如(NH4)2CO3、(NH4)2S等]、弱酸的酸式盐(如NaHCO3)均既能与强酸(H+)反应又能与强碱(OH―)反应,但它们不属于两性物质。
举一反三:
【变式1】氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是( )
A.加热使CuSO4·5H2O失水 B.加热使KMnO4分解
C.加热熔化烧碱 D.加热分解碱式碳酸铜
【答案】C
类型三:“铝三角”及其转化
例题3 向50 mL 1 mol·L―1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应后得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1 mol·L―1 B.3 mol·L―1 C.1.5 mol·L―1 D.3.5 mol·L―1
【答案】C、D
【解析】方法一:根据Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH溶液的两种情况:
(1)当加入KOH不足量时,
,
故。
(2)当加入KOH过量时,
n (KOH)=4n (Al3+)―n [Al(OH)3]=0.4 mol―0.05 mol=0.35 mol。
故。
方法二:用图像法求解,如图所示,用纵坐标表示生成的Al(OH)3的物质的量,横坐标表示KOH的物质的量。当生成沉淀0.05 mol时,需KOH的物质的量为0.15 mol或0.35 mol。
【总结升华】本题易漏选答案D,原因是未考虑到3.9 g沉淀可以是Al(OH)3被过量的KOH溶液溶解了一部分而剩余部分沉淀的情况。
举一反三:
【变式1】下列各组反应中能得到Al(OH)3的是( )
A.Al2O3加到热水中
B.向NaAlO2溶液中加入过量盐酸
C.将Na投入到NaAlO2溶液中
D.向AlCl3溶液中滴几滴NaOH溶液
【答案】D
【变式2】等体积的AlCl3和NaOH溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比为( )
A、1∶3 B、2∶3 C、1∶4 D、2∶7
【答案】B、D
【解析】AlCl3和NaOH溶液混和有沉淀物生成,可能有两种情况:①NaOH不足量,②NaOH部分过量。假设溶液中含有2mol的AlCl3,如果为第一种情况生成Al(OH)3沉淀的物质的量与未反应的AlCl3物质的量相等,所以耗NaOH 3mol。则答案为B。如果为第二种情况,则生成1mol的Al(OH)3,1mol的AlO2-,共消耗NaOH为7mol。所以答案为D。
类型四:与Al(OH)3、Al3+、AlO2―有关的图像
例题4 把x溶液(或气体)慢慢加入(或通入)到一定量的y溶液中,产生的沉淀量与加入x物质的量的关系如图所示,符合图中曲线的是( )
A、x为CO2,y为Ca(OH)2
B、x为NH3·H2O,y为AlCl3
C、x为NaOH,y为AlCl3
D、x为HCl,y为NaAlO2
【答案】D
【解析】CO2通入Ca(OH)2溶液中可产生碳酸钙沉淀,继续通CO2沉淀溶解而生成Ca(HCO3)2溶液。氨水加入AlCl3溶液产生沉淀,但过量不溶,方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
NaOH溶液滴加到AlCl3溶液中生成Al(OH)3沉淀,继续加入沉淀溶解生成偏铝酸盐。
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O
盐酸加入到NaAlO2溶液中,先生成Al(OH)3沉淀,继续加入沉淀溶解生成三价铝盐。
HCl+NaAlO2+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O
从观察方程式的系数,定量角度分析。
举一反三:
【变式1】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。试推断:
(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验操作为________。
【答案】(1)Al3+和Mg2+ (2)Fe3+、NH4+、Cu2+ (3)K+ (4)焰色反应
【解析】向溶液里加入过氧化钠粉末,会发生Na2O2和H2O的反应,生成NaOH和O2。因题目中没有刺激性气味气体产生,说明原溶液中不含有Fe3+和NH4+。又因生成的沉淀是白色的,所以原溶液中不含有Fe3+和Cu2+。根据图中曲线的变化,表明随Na2O2的加入(即NaOH的形成),白色沉淀逐渐增多,后来又逐渐减少,最后保持不变,说明原溶液中一定含有Al3+和Mg2+。K+可能存在,可通过焰色反应来检验。
规律总结:解答图像计算题,必须抓住有关化学原理和有关物质的性质,结合图像的特点,综合分析逐步计算求解,其关键是抓住图像四点(原点、交点、转折点、终点),数形结合,分析计算。
化学必修1第三章 金属及其化合物综合与测试导学案: 这是一份化学必修1第三章 金属及其化合物综合与测试导学案,共7页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试导学案: 这是一份高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试导学案,共7页。学案主要包含了学习目标,要点梳理,典型例题等内容,欢迎下载使用。
高中化学第三章 金属及其化合物综合与测试导学案: 这是一份高中化学第三章 金属及其化合物综合与测试导学案,共6页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。