
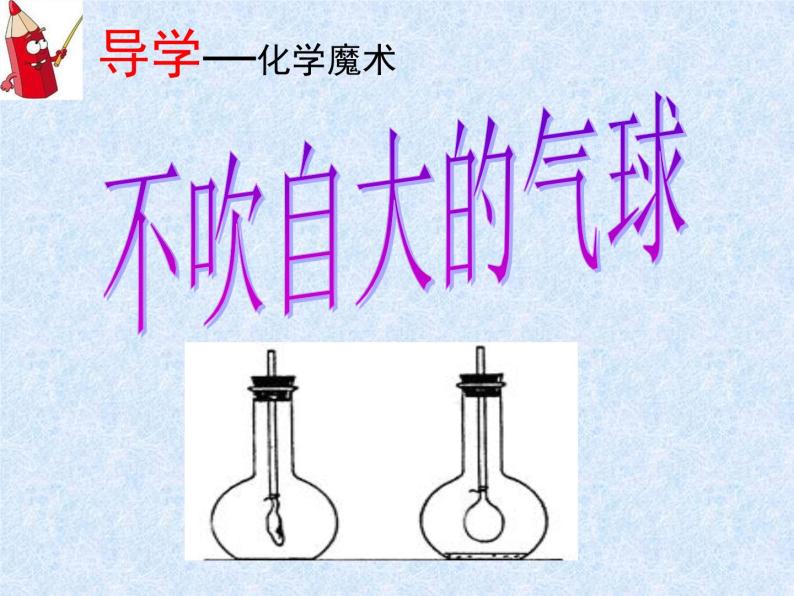





初中单元2 几种常见的酸和碱课文配套ppt课件
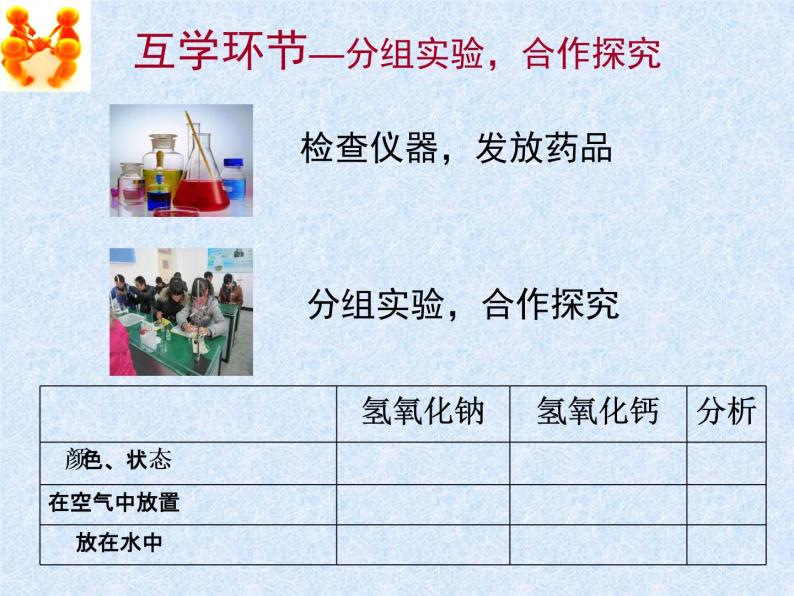
展开几种常见的酸和碱 (三)科普2011课标版九年级《化学》下册专题七单元2不吹自大的气球常见的含碱物质摸起来滑滑的生活中尝起来涩涩的不凑闻不触摸不尝味实验室常见的碱化学中是新朋友还是旧朋友?谈谈你已经知道什么?谈谈你还要探究什么?1.对氢氧化钠和氢氧化钙的使用要注意什么?独学成果汇报4.做课本实验有哪些注意事项?2.氢氧化钠和氢氧化钙各有哪些用途?3.可采用什么方法探究这两种物质的性质?1.对氢氧化钠和氢氧化钙的使用要注意什么?独学环节——阅读课本4.做课本实验有哪些注意事项?2.氢氧化钠和氢氧化钙各有哪些用途?3.可采用什么方法探究这两种物质的性质?互学环节—分组实验,合作探究检查仪器,发放药品分组实验,合作探究问题与交流3.氢氧化钠和氢氧化钙的俗称有哪些?你是怎样理解的?1.氢氧化钠固体表面为什么会变得潮湿?这水从哪里来?说明氢氧化钠有什么性质属于物理性质还是化学性质?利用这样的性质可以做什么?还有那些物质有类似的性质? 2.氢氧化钙遇水放热吗?它可用什么物质来制取?氢氧化钠——NaOH——腐蚀性俗称——苛性钠、火碱、烧碱 氢氧化钠氢氧化钙——Ca(OH)2——腐蚀性俗称——熟石灰、消石灰衣服破了戴手套氢氧化钙归纳总结——对子互查NaOHCa(OH)2苛性钠 火碱 烧碱熟石灰 消石灰白色固体(块状)白色固体(粉末)易溶于水微溶于水吸水性(潮解)CaO+H2O=Ca(OH)21.几种常见的碱化工原料(肥皂、石油、造纸、纺织、印染)、去除油污砌砖、粉墙、涂树、配波尔多液、改良酸性土壤等除了氢氧化钠、氢氧化钙之外,常见的碱还有哪些?这些碱有没有相似的化学性质呢 ?氨分子运动?酚酞变红色。继续探究,分享交流。2.碱的化学性质 碱溶液能使紫色石蕊试液变___色,碱溶液能使无色酚酞试液变___色。 装氢氧化钙溶液的试管中溶液变_______ 装氢氧化钠溶液的试管____明显现象。 蓝红无浑浊NaOH + CO2 ? 不吹自大的气球魔术大揭密小组——合作探究,画出方案 一、反应物的消耗(气压差) 二、生成物的检验鼓———瘪液面上升———液面下降液体倒吸—物体倒吸是否生成新物质——生成物的检验Ca(OH)2 + CO2 = CaCO3 ↓ + H2O2NaOH + CO2 = Na2CO3 + H2O澄清石灰水变浑浊倒入氢氧化钠溶液的塑料瓶变得更瘪一些,实施方案,展示交流2.你能完成下列化学反应吗? SO3 + 2NaOH = SO3 + Ca(OH)2 = CaSO4 + H2ONa2SO4+ H2O1. 氢氧化钠为什么要密封保存,为什么? 能用氢氧化钠固体干燥二氧化碳吗?为什么? 思考与启示:结论:碱溶液能与某些非金属氧化物反应CO2 + 2NaOH = Na2CO3 + H2O鼓———瘪液面上升———液面下降液体倒吸—物体倒吸生成物的检验——灭火器原理(一)升华大展示评学环节A——展示提升 启发探究 纸笔评价当堂检测对子互评反馈交流整理导学案作业设计落实基础★1.下列各组物质的名称或俗称和化学式表示的是同一种物质的是( ) A.熟石灰、消石灰、CaO B.铁锈、氧化铁、Fe(OH)3 C.生石灰、消石灰、Ca(OH)2 D.烧碱、火碱、NaOH2.下列关于氢氧化钠的描述中错误的是( ) A.易溶于水,溶解时放出大量的热 B.对皮肤有强烈的腐蚀作用 C.水溶液能使石蕊溶液变红 D.能去除油污,可做炉具清洁剂3.氢氧化钠固体可做干燥剂,下列不能用氢氧化钠固体干燥的气体有( ) A、氢气 B、二氧化硫 C、氧气 D、一氧化碳 发展能力★★4.鉴别氢氧化钠溶液和石灰水的方法为 , 有关方程式为_________________________________5.如图所示,若想小试管(试管中装有水)中分别加入一定量的下列物质,上 侧U型管中的液面左高右低,该物质是( ),左低右高的是( ) A.浓硫酸 B.食盐固体 C.硝酸铵固体 D.氢氧化钠固体 E.生石灰 F.氢氧化钠溶液提升素养★★★6.玻璃中含有SiO2,它是非金属氧化物,能与碱反应生成含硅酸根的化合物(SiO32-),所以实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞。写出SiO2与NaOH溶液反应的化学方程式__________。评学环节B——达标小测评对子交换,互学评价,小组评比1.D2.C3.B4.分别通入二氧化碳,变浑浊的是石灰水。Ca(OH)2 + CO2 = CaCO3 ↓ + H2O2NaOH + CO2 = Na2CO3 + H2O5. C A D E6. 2NaOH + SiO2 = Na2SiO3 + H2O谈谈本节课你有哪些收获?酚酞变红氢氧化钠(物性)白色块状固体易溶于水吸水———潮解 酸碱指示剂氢氧化钙(物性)白色固体粉末微溶于水 碱溶液化学性质 某些非金属氧化物碱板书设计:单元2 几种常见的酸和碱(三)课堂流程: 导学--- 独学------ 互学-------------- 评学--------石蕊变蓝Ca(OH)2+CO2=CaCO3↓+H2O2NaOH+CO2=Na2CO3↓+H2O制备:CaO+H2O=Ca(OH)2同学们,再见
仁爱湘教版九年级下册单元3 盐 化学肥料教课课件ppt: 这是一份仁爱湘教版九年级下册单元3 盐 化学肥料教课课件ppt
仁爱湘教版九年级下册单元1 酸性溶液和碱性溶液图片ppt课件: 这是一份仁爱湘教版九年级下册单元1 酸性溶液和碱性溶液图片ppt课件
初中化学仁爱湘教版九年级下册单元2 几种常见的酸和碱获奖课件ppt: 这是一份初中化学仁爱湘教版九年级下册单元2 几种常见的酸和碱获奖课件ppt,共27页。PPT课件主要包含了几种常见的碱,中和反应,课堂小结等内容,欢迎下载使用。













