
高中化学苏教版必修二专题1 微观结构与物质的多样性第一单元 原子核外电子排布与元素周期律学案及答案
展开课时2 元素周期律
班级_______学号_______姓名______________
[学习目标]
1、使学生初步掌握原子核外电子排布、原子半径和元素主要化合价与元素金属性、非金属性的周期性变化;
2、认识元素性质的周期性变化,是元素原子核外电子排布周期性变化的结果,从而理解元素周期律的实质;
3、培养学生的观察能力、分析能力和抽象思维的能力。
[课前准备]
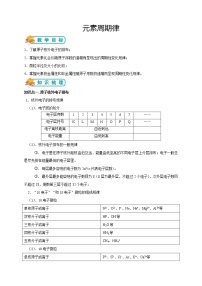
1~18号原子结构示意图
[学海导航]
二、元素周期律
(一)元素原子结构的变化规律
1、元素原子最外层电子数变化特点
原子序数 | 电子层数 | 最外层电子数 | 达到稳定结构时最外层电子数 |
1~2 |
|
|
|
3~10 |
|
|
|
11~18 |
|
|
|
结论:随着核电荷数的增加,原子的最外层电子排布呈 性变化。 | |||
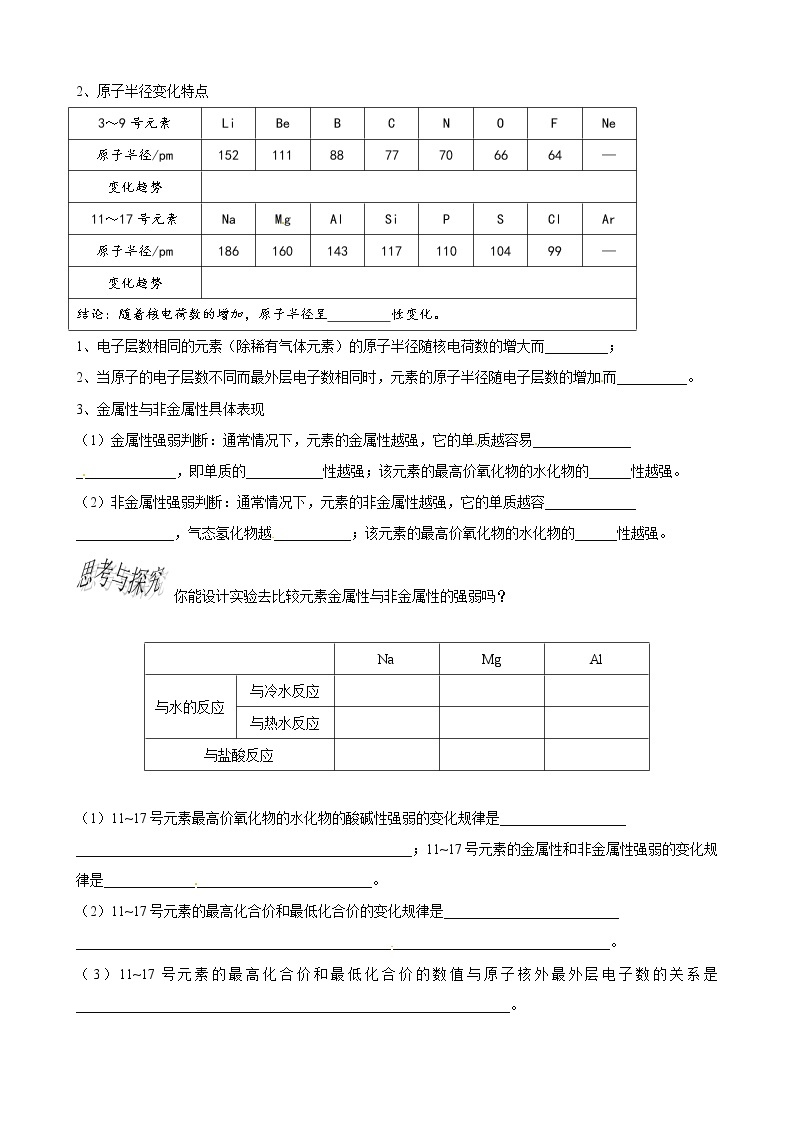
2、原子半径变化特点
3~9号元素 | Li | Be | B | C | N | O | F | Ne |
原子半径/pm | 152 | 111 | 88 | 77 | 70 | 66 | 64 | — |
变化趋势 |
| |||||||
11~17号元素 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子半径/pm | 186 | 160 | 143 | 117 | 110 | 104 | 99 | — |
变化趋势 |
| |||||||
结论:随着核电荷数的增加,原子半径呈 性变化。 | ||||||||
1、电子层数相同的元素(除稀有气体元素)的原子半径随核电荷数的增大而_________;
2、当原子的电子层数不同而最外层电子数相同时,元素的原子半径随电子层数的增加而__________。
3、金属性与非金属性具体表现
(1)金属性强弱判断:通常情况下,元素的金属性越强,它的单质越容易______________
______________,即单质的___________性越强;该元素的最高价氧化物的水化物的______性越强。
(2)非金属性强弱判断:通常情况下,元素的非金属性越强,它的单质越容_____________
______________,气态氢化物越___________;该元素的最高价氧化物的水化物的______性越强。
你能设计实验去比较元素金属性与非金属性的强弱吗?
| Na | Mg | Al | |
与水的反应 | 与冷水反应 |
|
|
|
与热水反应 |
|
|
| |
与盐酸反应 |
|
|
| |
(1)11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律是__________________
________________________________________________;11~17号元素的金属性和非金属性强弱的变化规律是______________________________________。
(2)11~17号元素的最高化合价和最低化合价的变化规律是_________________________
____________________________________________________________________________。
(3)11~17号元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系是______________________________________________________________。
[学业测试]
一、选择题
1.元素周期律的实质是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素化合价呈周期性变化
2.下列有关元素周期律的叙述正确的是 ( )
A.随着原子序数的递增,原子最外层电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随着原子序数的递增,元素额的最高正价从+1到+7,负价从-7到-1重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化等。
3.下列各组指定原子序数的元素,不能形成AB2型化合物的是 ( )
A.6和8 B.16和8 C.12和9 D.11和16
4.下列叙述不正确的是 ( )
A.13C和14C属于同一元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
5.在前18号元素中,原子最外层电子层只有1个或2个电子的元素是 ( )
A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定哪类元素
6.原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有 ( )
A.1种 B.2种 C.3种 D.4种
7.下列叙述中,可以肯定金属A比金属B的活动性强的是 ( )
A.A原子最外层电子数比B原子最外层电子数少
B.A的最高价氧化物对应水化物的碱性强于B的最高价氧化物对应水化物的碱性
C.1molA与酸反应生成的H2比1molB与酸反应生成的H2多
D.常温时,A能从水中置换出氢气,而B不能
8.下列能说明氯元素的非金属性比硫元素强的事实是 ( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl原子最外层有7个电子,S原子最外层有6个电子 ⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
9.下列有关元素性质的递变规律不正确的是 ( )
A.Na、Mg、Al的还原性逐渐减弱
B.HCl、PH3、H2S气态氢化物的稳定性逐渐减弱
C.NaOH、KOH的碱性逐渐增强
D.Na、K、Rb的原子半径依次增大
10.A、B、C、 D 四种原子序数小于18 的元素,其离子 aA+、bB2+、cC-、dD2-具有相同的电子层结构,下列判断正确的是 ( )
A.原子序数由大到小的顺序是:b<a<c<d
B.离子半径由大到小的顺序是:B2+>A+>C->D2-
C.A、B、C、D四种元素原子具有相同的电子层数
D.金属性A>B,非金属性C>D
二、填空题
11.在1~18号元素中,最外层电子数是次外层电子数一半的元素有_________________;
最外层电子数是内层电子数一半的元素有_____________________________________。
12.现有部分原子序数小于18 的元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 最外层电子数比次外层电子数少5个电子 |
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是_____(用元素符号表示)
元素Z的离子结构示意图为______________。
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:
_________________________________________________________________。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:
_________________________________________________________________。
(4)元素X与元素Y相比,非金属性较强的是___________(用元素符号表示),下列表述中能证明这一事实的是_____________________。
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是_________________(用元素符号表示),理由_______________________________________________。
13.某同学想通过比较两种最高价氧化物的水化物的酸性强弱来验证硫与碳的得电子能力的强弱,它采用了如图所示的装置进行试验。请回答:
(1)仪器a的名称是____________,应盛放下列药品中的_______。
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是____________,应盛放下列药品中的______。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的药品是____________,如果看到的现象是
____________________,证明b中反应产生了_____________
___________________,即可证明__________比_________酸性
强,非金属性__________比__________强,b中发生反应的离子方程式为
_____________________________________________________________________
14.在水溶液中,YO3n-和S2-发生反应的离子方程式如下:
YO3n-+3S2-+6H+==Y-+3S↓+3H2O
(1)YO3n-中Y元素的化合价是___________
(2)Y元素原子的最外层电子数是__________
(3)比较S2-和Y-的还原性______________________
参考答案:
11.Li Si;Li P
12.(1),
(2)向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在该离子,反之,不存在该离子。
(3)Al(OH)3+OH-==AlO2-+2H2O
(4)N;bc
(5)Al,Al为金属单质,其余为非金属单质。
13.(1)分液漏斗,A
(2)烧瓶,D
(3)澄清石灰水,生成白色沉淀,CO2,H2SO4 H2CO3 ,S C,
CO32-+2H+==CO2↑+H2O
14.(1)+5 (2)7 (3)S2-<Y-
人教版 (2019)必修 第一册第一节 物质的分类及转化导学案: 这是一份人教版 (2019)必修 第一册第一节 物质的分类及转化导学案,共5页。学案主要包含了分散系基本概念及分类,活动探究,课后作业,练习与检测等内容,欢迎下载使用。
高考化学 考点27 元素周期律及其应用学案(含解析): 这是一份高考化学 考点27 元素周期律及其应用学案(含解析),共6页。学案主要包含了元素周期律,元素周期律的应用等内容,欢迎下载使用。
高中化学第二节 原子结构与元素的性质第2课时学案: 这是一份高中化学第二节 原子结构与元素的性质第2课时学案,共19页。