


【培优导学案】浙教版科学九年级全册:3、几种重要的盐 学案(含解析)
展开几种重要的盐
【回顾】
一、复分解反应
1.概念:两种化合物互相交换成分,生成两种新化合物的反应,称为复分解反应。通式:AB+CD===AD+CB。
例如:Na2CO3+CaCl2===CaCO3↓+2NaCl。
2.复分解反应发生的条件
反应类型 | 反应物条件 | 生成物条件 |
盐+盐―→ 新盐+新盐 | 两种都可溶 | 至少具备下列三个条件中的一个:①有沉淀生成;②有气体放出;③有水生成 |
盐+碱―→ 新盐+新碱 | 两种都可溶 | |
盐+酸―→ 新盐+新酸 | 盐可溶或难溶(但可溶于酸),酸必须可溶 | |
酸+碱―→ 盐+水 | 酸、碱至少有一种可溶 |
二、离子的检验方法
1.CO32-的检验方法:向待测样品中滴加稀盐酸,若观察到产生大量气泡,将产生的气体通入澄清石灰水中,如果澄清石灰水变浑浊,则样品中含有CO32-。
2.SO42-的检验方法:向待测样品中滴加BaCl2[或Ba(NO3)2]溶液和稀硝酸,若观察到产生白色沉淀,则样品中含有SO42-。
3.Cl-的检验方法:向待测样品中加入AgNO3溶液和稀硝酸,若观察到有白色沉淀产生,则样品中含有Cl-。
注意:检验Cl-和SO42-时,要加入几滴稀硝酸,目的是排除CO32-等杂质离子的干扰。因为CO32-与AgNO3或BaCl2溶液反应时,也有白色沉淀Ag2CO3、BaCO3生成,但这些沉淀都溶于稀硝酸。溶液中若同时有SO42-和Cl-需要检验,应该先用Ba(NO3)2溶液(不能用BaCl2溶液)和稀硝酸检验并除去SO42-。然后向滤液中滴加AgNO3溶液检验Cl-。因为Ag2SO4微溶于水,若原溶液中SO42-浓度较大,如果先检验Cl-,加入AgNO3溶液时,就会生成Ag2SO4(微溶)沉淀,从而干扰对Cl-的检验。
4.NH4+的检验方法:将待测样品与氢氧化钠(或氢氧化钙)混合加热后,有刺激性气味的气体产生,产生的气体能使湿润的红色石蕊试纸变蓝,则样品中含有NH4+。
注意:铵态氮肥不能和碱性物质,如草木灰(K2CO3)一起施用,否则会降低肥效。
5.Fe3+的检验方法:向待测样品中滴加氢氧化钠溶液,若出现红褐色沉淀,则说明样品中含有Fe3+。
6.Cu2+的检验方法:向待测样品中滴加氢氧化钠溶液,若出现蓝色絮状沉淀,则说明样品中含有Cu2+。
三、侯氏制碱法生产过程
①NaCl+NH3+CO2+H2O===NH4Cl+NaHCO3↓;
②2NaHCO3Na2CO3+H2O+CO2↑。
制得的是工业用的纯碱。
![]()
例1 家庭生活中制作食品经常用到碳酸钠(纯碱)和碳酸氢钠(小苏打),碳酸氢钠不稳定,在潮湿空气中缓慢分解,受热易分解,65 ℃以上迅速分解,270 ℃时完全分解为碳酸钠。某同学为探究它们的性质差异,设计了如图3-1所示装置进行实验。请回答:
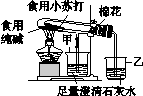
图3-1
(1)加热一段时间后,甲、乙两烧杯中的现象分别是________________________________
________________________。由此可得出的结论是_______________________________。
(2)写出发生反应的化学方程式:________________________________________。
(3)该装置设计的优点是___________________________________________________。
[答案] (1)甲中石灰水不变浑浊,乙中石灰水变浑浊 碳酸氢钠易分解,碳酸钠不易分解
(2)2NaHCO3Na2CO3+H2O+CO2↑
(3)可通过对比现象确定两种物质的热稳定性
(1)根据信息可知碳酸氢钠不稳定,在潮湿空气中缓慢分解,受热易分解,65 ℃以上迅速分解,270 ℃时完全分解为碳酸钠,同时产生二氧化碳和水,因此与碳酸氢钠相连的乙烧杯中的石灰水会变浑浊,而与碳酸钠相连的甲烧杯中的石灰水无明显变化。(3)此装置把两个独立的装置合为一个装置,可通过明显的现象对比确定两种物质的热稳定性。
例2 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
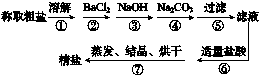
图3-2
(1)步骤①⑤⑦中都用到的一种玻璃仪器为______________。
(2)判断BaCl2已过量的方法是____________________________________________________
________________________________________________________________________。
(3)第④步中,相关的化学方程式为____________________________________________;________________________________________。
[答案] (1)玻璃棒
(2)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
(3)CaCl2+Na2CO3===CaCO3↓+2NaCl BaCl2+Na2CO3===BaCO3↓+2NaCl
(1)在①溶解、⑤过滤、⑦蒸发、结晶、烘干的步骤中分别需要用玻璃棒搅拌、引流、搅拌。(2)氯化钡过量时,溶液中不会含有硫酸根离子,可以通过检验是否含有硫酸根离子来确定氯化钡是否过量。(3)碳酸钠的作用是将溶液中的钙离子和过量的钡离子沉淀下来,发生反应的化学方程式为:CaCl2+Na2CO3===CaCO3↓+2NaCl;BaCl2+Na2CO3===BaCO3↓+2NaCl。
[方法点拨] 粗盐提纯涉及多步除杂,加入的除杂试剂均过量,明确氯化钡溶液要加在碳酸钠溶液的前面。
![]()
1.提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
A.过滤、蒸发、结晶、溶解
B.溶解、蒸发、过滤、结晶
C.溶解、蒸发、结晶、过滤
D.溶解、过滤、蒸发、结晶
2.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
3.如图3-3所示,X溶液与AgNO3、Na2CO3、Na2SO4三种溶液发生反应均生成白色沉淀,则X可能是( )
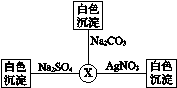
图3-3
A.KNO3 B.H2SO4
C.BaCl2 D.NaOH
4.某溶液中含有Ba2+、Ag+、Cu2+,现有①NaOH溶液,②Na2SO4溶液,③盐酸,将三种离子逐一沉淀并加以分离,则加入试剂的顺序正确的是( )
A.①②③ B.③②①
C.②③① D.②①③
5.某化肥包装袋上的部分说明如图3-4所示:

图3-4
(1)硝酸铵属于化肥中的________(填序号)。
A.钾肥 B.氮肥 C.磷肥
(2)硝酸铵应具有的性质是________(填序号)。
A.易溶于水 B.有挥发性
C.受热易分解
(3)硝酸铵能与强碱反应,其中与烧碱反应的化学方程式为:NH4NO3+NaOH===NaNO3+NH3↑+X,则X的化学式为________;施用该类肥料时,要避免与________(填“酸”或“碱”)性物质混用,否则会降低肥效。
6.烧杯中装有一定量的Na2CO3溶液,向其中加入一定量的CaCl2溶液,充分反应后过滤,得到滤渣和滤液,现对滤液中溶质的成分进行探究:
[提出猜想]
猜想1: 滤液中的溶质为NaCl;
猜想2: 滤液中的溶质为NaCl、CaCl2;
猜想3: 滤液中的溶质为_______________________________________;
猜想4: 滤液中的溶质为NaCl、CaCl2、Na2CO3。
(1)完成猜想3。
(2)同学们一致认为,猜想4有明显的错误,其原因是________________________________________________________________________。
[设计实验,验证猜想]
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向滤液中滴加适量的Na2CO3溶液 | (3)_____________________________ _______________________________ | 猜想2 成立 |
取少量滤液于试管中,向滤液中滴加适量的稀盐酸 | (4)_____________________________ _______________________________ | 猜想3 成立 |
[反思与评价]
(5)当NaCl溶液中混有少量的Na2CO3溶液时,可选用__________除去Na2CO3杂质。(多选题)
A.稀盐酸 B.CaCl2溶液
C.BaCl2溶液 D.Ba(OH)2溶液
7.食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
―→―→
图3-5
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和________。
②在蒸发过程中,待____________________时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图3-6所示。

图3-6
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____________________________(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____________________(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是________________________。(已知:20 ℃时氯化钠的溶解度为36 g)
8.1926年我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O===NH4Cl+NaHCO3↓;
②2NaHCO3Na2CO3+H2O+CO2↑。
(1)侯氏制碱法所制的“碱”是指________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,首先从溶液中结晶析出的是____________(填物质名称)晶体。
(3)现有Na2CO3和NaCl的混合物样品22.3 g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图3-7所示。试回答下列问题。
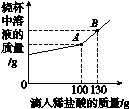
图3-7
①当滴入上述稀盐酸至图中B点时,烧杯内溶液中的溶质为________________________(写化学式)。
②在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量。(计算结果精确至0.1 g)
9.为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10 g食用纯碱样品(配成溶液)和足量的溶质质量分数为10%的稀硫酸,进行如图3-8甲所示实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他物质不与稀硫酸反应)
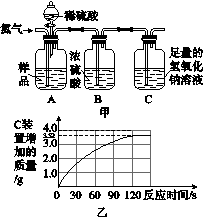
图3-8
(1)实验前,先往A装置通入一会氮气的目的是________________________________________。
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由:________________________________________________________________________
________________________________________________________________________。
答案
1.D 粗盐提纯:利用混在食盐中的泥沙不能溶于水的特点,可先把粗盐放入水中溶解,使食盐与泥沙进行初步分离;再经过过滤除去溶液中不溶的泥沙;最后经过蒸发,把溶解在水中的食盐结晶分离出来。
2.D 为了除去粗盐中的Ca2+、Mg2+、SO42-,需将它们变为沉淀物除去且不能引入新的杂质。①过滤可以除去生成的沉淀物,应在Ca2+、Mg2+、SO42-变为沉淀物之后、加入盐酸之前进行;②加过量NaOH溶液,能将Mg2+转变成Mg(OH)2沉淀;③加适量盐酸能除去过量的NaOH和Na2CO3,且生成物为NaCl,无杂质产生,但需要将沉淀物过滤之后添加,以免将沉淀重新转化为杂质离子;④加过量Na2CO3溶液,能和Ca2+反应生成CaCO3沉淀,且能除去过量BaCl2中的Ba2+,应在加入过量BaCl2之后进行;⑤BaCl2能和SO42-反应生成BaSO4沉淀。
3.C BaCl2溶液与AgNO3、Na2CO3、Na2SO4三种溶液发生反应生成的白色沉淀分别是:AgCl、BaCO3、BaSO4,故X溶液可能是BaCl2。
4.B 若先加NaOH溶液,则会生成由AgOH脱水而成的Ag2O沉淀和Cu(OH)2沉淀,不能逐一分离沉淀;若首先加入Na2SO4溶液,会同时生成BaSO4沉淀和Ag2SO4沉淀(Ag2SO4微溶);若先加入盐酸,分离出AgCl沉淀,余下Ba2+和Cu2+,加入Na2SO4溶液,则生成BaSO4,再加入NaOH溶液,则会生成Cu(OH)2沉淀,可将其逐一沉淀,加以分离。
5.(1)B (2)AC (3)H2O 碱
(3)根据质量守恒定律可知,反应物中一共有2个N、5个H、4个O、1个Na,生成物中一共有2个N、3个H、3个O、1个Na,反应物比生成物多2个H和1个O,所以X的化学式为H2O;由上述反应可知,硝酸铵可以和碱性物质反应生成氨气,降低肥效,因此在施用该肥料时,要避免和碱性物质混用。
6.(1)NaCl、Na2CO3 (2)碳酸钠和氯化钙会发生化学反应,两者不能同时存在 (3)有白色沉淀产生 (4)有气泡产生 (5)ABC
(1)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,若碳酸钠过量,则含有的溶质是氯化钠和碳酸钠。(2)由于碳酸钠和氯化钙混合会发生反应生成碳酸钙沉淀,故猜想4错误。(3)若氯化钙存在,则加入碳酸钠溶液会产生白色沉淀。(4)若碳酸钠存在,则加入盐酸会产生气泡。(5)要除去氯化钠中混有的碳酸钠,所加入的试剂要能与碳酸钠反应且不能生成新的杂质,盐酸和碳酸钠反应生成氯化钠和水以及二氧化碳,且不引入新的杂质,使用盐酸可以除去碳酸钠;氯化钙溶液和碳酸钠反应生成碳酸钙沉淀和氯化钠,不引入新的杂质,可以使用氯化钙溶液除去碳酸钠;氯化钡溶液与碳酸钠反应生成碳酸钡沉淀和氯化钠,不引入新的杂质,可以使用氯化钡除去碳酸钠;氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,会引入新的杂质氢氧化钠,不能使用氢氧化钡除去碳酸钠。
7.(1)①漏斗 ②蒸发皿中出现较多固体
(2)①BaCl2+Na2CO3===BaCO3↓+2NaCl
②Na2CO3、NaCl、NaOH
(3)加入22.4 kg氯化钠固体
(1)①操作Ⅰ是过滤,过滤所需要的玻璃仪器有玻璃棒、烧杯和漏斗。②在蒸发过程中,待蒸发皿中出现较多固体时停止加热,利用余热将滤液蒸干。(2)①碳酸钠可以和氯化钙或氯化钡反应生成沉淀,从而除去粗盐中的氯化钙和过量的氯化钡。②粗盐中的杂质氯化镁与氢氧化钠反应生成氯化钠和氢氧化镁沉淀,硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,氯化钙与碳酸钠反应生成氯化钠和碳酸钙沉淀,过量的氯化钡与碳酸钠反应生成氯化钠和碳酸钡沉淀,反应后经过过滤除去沉淀,剩余的是大量的氯化钠和少量的碳酸钠和氢氧化钠。(3)可以通过加入溶质的方法使不饱和溶液变成饱和溶液。设加入溶质的质量为x,则=,解得x=22.4 kg。
8.(1)碳酸钠(或Na2CO3) (2)碳酸氢钠
(3)①NaCl、HCl ②10.6
③解:滴入上述稀盐酸至图中A点时,溶液中只有NaCl一种溶质。
设反应生成NaCl的质量为x。
2HCl+Na2CO3===2NaCl+H2O+CO2↑
73 117
100 g×7.3% x
= x=11.7 g
此温度时所得不饱和溶液中溶质的质量为:11.7 g+(22.3 g-10.6 g)=23.4 g。
答:此温度时所得不饱和溶液中溶质的质量为23.4 g。
(1)侯氏制碱法制取的是纯碱,即Na2CO3。(2)常温下,氯化铵的溶解度较大,碳酸氢钠的溶解度较小,故碳酸氢钠会首先从溶液中析出。(3)①滴入上述稀盐酸至图中B点时,Na2CO3已反应完全,溶液中溶质为NaCl和过量的HCl。
②滴入上述稀盐酸至图中A点时,Na2CO3恰好完全反应。设混合物样品中含有Na2CO3的质量为y。
Na2CO3+2HCl===2NaCl+CO2↑+H2O
106 73
y 100 g×7.3%
= y=10.6 g
9.(1)排净瓶内空气,避免装置内原有的二氧化碳对实验产生干扰
(2)解:由图可以知道生成二氧化碳的质量为3.52 g。
设纯碱样品中含碳酸钠的质量为x。
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
106 44
x 3.52 g
=
x=8.48 g
该食用纯碱中碳酸钠的质量分数为:×100%=84.8%。
答:该食用纯碱中碳酸钠的质量分数是84.8%。
(3)浓盐酸具有挥发性,挥发出的HCl气体被C装置中的氢氧化钠溶液吸收
【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:5、离子共存问题 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:5、离子共存问题 学案(含解析),共7页。
【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析),共8页。













